Trước đó, thu hồi 11 loại thuốc chữa dạ dày có thành phần Ranitidine do có chứa tạp chất N-nitrosodimethylamine (NDMA) có nguy cơ gây ung thư ở hàm lượng vượt quá ngưỡng cho phép của quốc tế. Có xuất xứ từ Ấn Độ, Tây Ban Nha, Italia, Anh, Thái Lan, Malaysia.
Mới đây, Cục Quản lý Dược (Bộ Y tế) vừa có văn bản gửi Sở Y tế các tỉnh, thành phố trực thuộc trung ương yêu cầu đình chỉ lưu hành toàn quốc thuốc Desratel (Desloratadin 5mg) và thuốc Cetirizin (Cetirizine 2HCL 10mg) do không đạt tiêu chuẩn chất lượng.
 Theo đó, căn cứ vào quy chế dược hiện hành và công văn gửi kèm phiếu kiểm nghiệm của Viện Kiểm nghiệm thuốc TP. Hồ Chí Minh báo cáo lô thuốc viên nén bao phim Desteral (Desloratadin 5mg), SĐK: VD-28452-17, Số lô: 190157; HD: 19/2/2022 do Công ty cổ phần dược phẩm Đạt Vi Phú sản xuất và mẫu thuốc do Viện kiểm ngiệm thuốc TP. Hồ Chí Minh lấy tại Công ty cổ phần dược phẩm Đạt Vi Phú, phát hiện thuốc không đạt tiêu chuẩn về chỉ tiêu định lượng (vi phạm mức độ 2).
Theo đó, căn cứ vào quy chế dược hiện hành và công văn gửi kèm phiếu kiểm nghiệm của Viện Kiểm nghiệm thuốc TP. Hồ Chí Minh báo cáo lô thuốc viên nén bao phim Desteral (Desloratadin 5mg), SĐK: VD-28452-17, Số lô: 190157; HD: 19/2/2022 do Công ty cổ phần dược phẩm Đạt Vi Phú sản xuất và mẫu thuốc do Viện kiểm ngiệm thuốc TP. Hồ Chí Minh lấy tại Công ty cổ phần dược phẩm Đạt Vi Phú, phát hiện thuốc không đạt tiêu chuẩn về chỉ tiêu định lượng (vi phạm mức độ 2).
Do đó, Cục Quản lý Dược đã có văn bản số số 16811/QLD-CL yêu cầu thu hồi toàn quốc viên nén bao phim Desteral (Desloratadin 5mg) do Công ty cổ phần dược phẩm Đạt Vi Phú sản xuất.
Trong thời hạn 48h kể từ ngày ký công văn, Cục Quản lý dược yêu cầu Công ty cổ phần dược phẩm Đạt Vi Phú cùng các nhà phân phối thuốc phải gửi thông báo thu hồi tới các cơ sở bán buôn, bán lẻ, sử dụng viên nén bao phim Desteral. Cùng với đó, gửi báo cáo thu hồi về Cục quản lý Dược trong vòng 18 ngày kể từ ngày ký công văn.
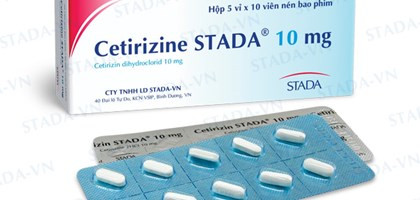
Cùng với đó, Cục Quản lý Dược, Bộ Y tế, vừa có công văn 16912/QLD-CL về việc đình chỉ lưu hành thuốc không đạt tiêu chuẩn chất lượng đối với thuốc Cetirizin của Công ty cổ phần Dược phẩm 3/2. Quyết định thu hồi thuốc Cetirizin này căn cứ Công văn của Viện kiểm nghiệm thuốc TP HCM gửi kèm phiếu kiểm nghiệm số 0595/VKN-KT2019 báo cáo lô thuốc Viên nén dài bao phim Cetirizin (Cetirizine 2HCl 10mg), SĐK: VD-19303-13, số lô: 002171, HD: 14/4/2020 do Công ty cổ phần Dược phấm 3/2 sản xuất.
Mẫu thuốc do Viện Kiểm nghiệm thuốc TP Hồ Chí Minh lấy tại Công ty cổ phần Dược phẩm 3/2, 601 Cách Mạng Tháng Tám, P15, Quận 10, TP HCM. Kết quả, thuốc không đạt tiêu chuẩn chất lượng về chỉ tiêu độ hòa tan (vi phạm mức độ 3).
Với kết quả này, Cục Quản lý Dược thông báo thu hồi toàn quốc lô thuốc Viên nén dài bao phim Cetirizin (Cetirizine 2HC1 lOmg), SĐK: VD-19303-13, số lô: 002171, HD: 14-4-2020 do Công ty cổ phần Dược phẩm 3/2 sản xuất. Công ty cổ phần Dược phẩm 3/2 phối hợp với nhà phân phối thuốc phải gửi thông báo thu hồi tới các cơ sở bán buôn, bán lẻ, sử dụng và tiến hành thu hồi toàn bộ lô thuốc không đạt tiêu chuẩn chất lượng nêu trên.
Cục yêu cầu Công ty cổ phần Dược phẩm 3/2 phải gửi báo cáo thu hồi về Cục Quản lý Dược trong vòng 33 ngày kể từ ngày ký Công văn, hồ sơ thu hồi bao gồm số lượng sản xuất, số lượng phân phối, ngày sản xuất, số lượng thu hồi, các bằng chứng về việc thực hiện thu hồi tại các cơ sở bán buôn, bán lẻ, sử dụng đã mua thuốc theo quy định.
Các Sở Y tế các tỉnh thành phố trực thuộc Trung ương, y tế các ngành thông báo cho các cơ sở kinh doanh, sử dụng thuốc thu hồi lô thuốc không đạt chất lượng nêu trên, kiểm tra và giám sát các đơn vị thực hiện thông báo này; xử lý những đơn vị vi phạm theo quy định hiện hành; báo cáo về Cục Quản lý Dược và các cơ quan chức năng có liên quan.
Cục cũng đề nghị Sở Y tế TP Hồ Chí Minh kiểm tra và giám sát Công ty cổ phần Dược phấm 3/2 thực hiện việc thu hồi và xử lý thuốc bị thu hồi theo quy định.
Minh Anh (T/h)













![[Góc nhìn tuần qua]: Đại hội XIV của Đảng “Thống nhất ý chí, khơi dậy khát vọng phát triển” [Góc nhìn tuần qua]: Đại hội XIV của Đảng “Thống nhất ý chí, khơi dậy khát vọng phát triển”](https://mtcs.1cdn.vn/thumbs/540x360/2026/01/24/dai-hoi-1.jpg)